Меню
 БИОРИТМ
ООО "МФК БИОРИТМ"
БИОРИТМ
ООО "МФК БИОРИТМ"

ФАС России возбудила первое дело о заключении картеля между оптовыми поставщиками медицинских масок в Санкт-Петербурге. Цена была превышена в 1,5 раза, сообщил начальник Управления по борьбе с картелями Андрей Тенишев во время пресс-конференции в ИА «Росбалт» 13 февраля.
«Самое парадоксальное, что максимальное завышение цен на медицинские маски произошло не в тех регионах, которые граничат с Китаем, — рассказал Андрей Тенишев. — Там как раз рост цен незначительный. Зато самое большое подорожание произошло в Дагестане и Санкт-Петербурге».
Представитель ФАС признал, что в некоторых территориях подорожание медицинских масок произошло на фоне ажиотажного спроса, но «где-то — просто сговариваются и на беде наживаются».
- Создано: 14.02.2020

Отказ Министерства труда и благосостояния Японии от обязательной вакцинации против вируса папилломы человека (ВПЧ) девушек-подростков в 2013 году, может привести к трагическим последствиям, пишет Reuters.
По мнению экспертов, политика японских властей может привести более чем к 24,6 тыс. случаев рака шейки матки и 10,8 тысячам смертей, которых можно было бы избежать.
Минздрав Японии отозвал рекомендации по обязательной вакцинации против ВПЧ в 2013 году из-за сообщений о побочных эффектах вакцин. Охват вакцинацией к тому времени составлял 70%. После решения Минздрава этот показатель упал до 1% и сохраняется на этом уровне.
Ежегодно в Японии рак шейки матки диагностируют примерно у 10 тыс. женщин, умирают от этого заболевания 3 тыс. пациенток.
Отзыв рекомендаций не является полным запретом на вакцинацию против ВПЧ. Желающие могут прививаться за свой счет.
В ноябре 2019 года мэр Токио и еще восемь руководителей префектур подписали письмо в поддержку обязательной вакцинации против ВПЧ.
- Создано: 14.02.2020
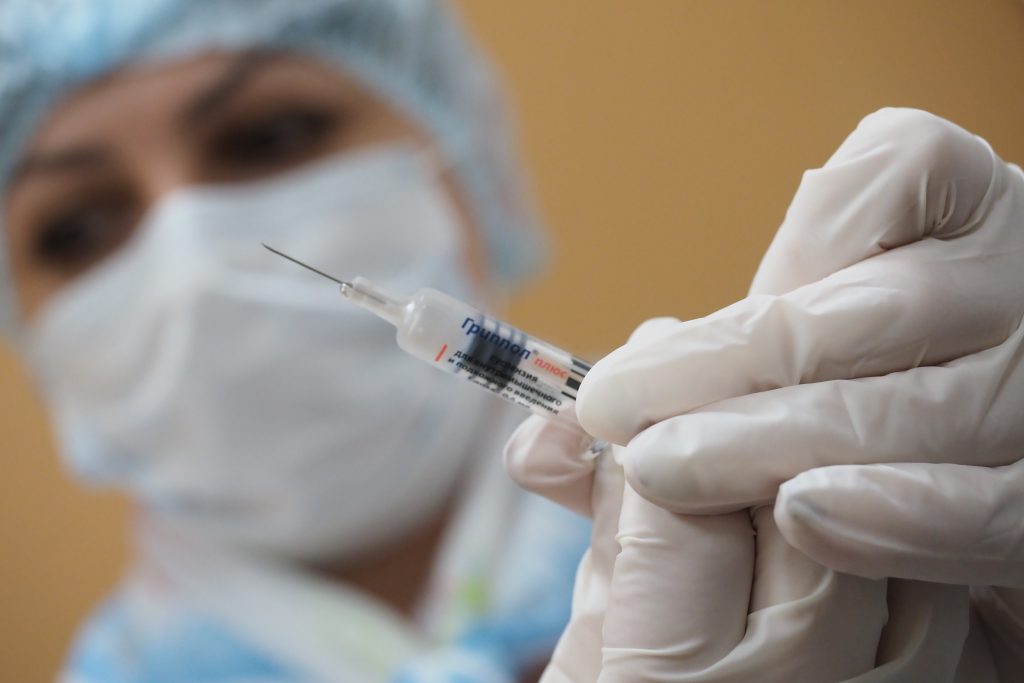
Столичных родителей призвали отправить своих шести- и семилетних детей на дополнительную прививку от коклюша.
Вторая ревакцинация включена в региональный календарь и проводится абсолютно бесплатно. Комбинированная вакцина также подходит для профилактики дифтерии и столбняка.
Как рассказала заммэра Москвы по вопросам социального развития Анастасия Ракова, столица является одним из первых российских регионов, использующих новую вакцину.
– Прививка позволит значительно снизить заболеваемость коклюшной инфекцией среди дошкольников и младших школьников, – пояснила она, добавив, что процедура проходит в детских поликлиниках по месту прикрепления и образовательных организациях.
Известно, что иммунитет многих детей начинает хуже противостоять недугу к шести-семи годам. В этом возрасте они уже ходят в школу, что усиливает опасность заражения. До конца года вакцинацию пройдут около 90 тысяч мальчиков и девочек.
Сайт газеты «Москва.Центр» напоминает, что пользователи портала «Активный гражданин» могут оставить заявку на прививку для домашних животных.
- Создано: 14.02.2020

Росздравнадзор утвердил Порядок оценки объема испытаний качества иммунобиологических лекарственных препаратов Комиссией Федеральной службы по надзору в сфере здравоохранения по качеству иммунобиологических лекарственных препаратов. Соответствующий приказ Росздравнадзора № 9452 от 17.12.2019 30 декабря зарегистрировал Минюст России.
Оценка объема испытаний качества проводится в отношении иммунобиологических лекарственных препаратов (ИБЛП), данные о которых внесены в Государственный реестр лекарственных средств и сведения о выпуске в гражданский оборот которых внесены в автоматизированную информационную систему Росздравнадзора.
- Создано: 13.01.2020

Правительство предложило довести годовой объем закупок товаров, произведенных в странах ЕАЭС, до 50% от всего объема. Это следует из поправок в ФЗ №44 «О контрактной системе». Это проект Минпромторга, рассказал участник фармрынка, знакомый с ситуацией. Документ есть у «ФВ», его подлинность подтвердил источник, близкий к ведомству.
Эти поправки предлагается внести в ст.14 «Применение национального режима при осуществлении закупок», которая распространяется на все типы товаров, в том числе на лекарственные препараты и медицинские изделия. Наличие 50% в закупках товаров должны будут обеспечить как госзаказчики федерального уровня, так и региональные и муниципальные.
- Создано: 13.01.2020

Правительство РФ установило особенности внедрения системы цифровой маркировки и прослеживания лекарств.
С учетом успешного опыта по запуску маркировки препаратов группы 7ВЗН с 1 октября 2019 года, 31 декабря 2019 года было подписано Постановление Правительства РФ №1954 определяющее оптимальный режим подготовки всех участников оборота к дате обязательной маркировки всех препаратов. В соответствии с ними с 1 января и до конца февраля 2020 года все участники оборота лекарств должны зарегистрироваться в системе маркировки. С 1 июля 2020 года будет запрещен оборот лекарств без цифровых кодов. Постановление вступает в силу с даты опубликования.
- Создано: 13.01.2020

Лекарства для лечения высокозатратных нозологий, произведенные до 31 декабря 2019 года, а также иные лекарственные препараты, произведенные до 1 июля 2020 года, могут получить возможность находиться в обороте без нанесения средств идентификации до истечения срока их годности.
Сегодня состоится заседание совета Госдумы, на котором планируется рассмотреть проект федерального закона № 346344-7 «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и Федеральный закон «О внесении изменений в Федеральный закон «Об обращении лекарственных средств». Ко второму чтению законопроекта в него внесен рад поправок. В частности, часть 71 статьи 67 предлагается изложить в следующей редакции:
- Создано: 09.12.2019

Росздравнадзор утвердил форму выдаваемого ведомством разрешения на ввод в гражданский оборот в РФ серии или партии произведенного в РФ или ввозимого в страну иммунобиологического лекарственного препарата, а также форму выдаваемого федеральным государственным бюджетным учреждением, осуществляющим испытания качества препарата, заключения о соответствии серии или партии препарата требованиям, установленным при его госрегистрации.
В соответствии с приказом Росздравнадзора № 8966 от 29.11.2019, в разрешении на ввод партии в оборот указываются сведения о препарате, сроке годности, его производителе и держателе регистрационного удостоверения. Разрешение выдается на срок годности серии или партии иммунобиологического лекарственного препарата, на которую выдается разрешение.
Заключение выдается по результатам испытаний и включает в себя, в частности, МНН препарата, сведения о лекарственной форме, форме выпуска, номере и объеме серии (партии), дате выпуска и сроке годности, о производителе и держателе регистрационного удостоверения и их адреса.
- Создано: 09.12.2019
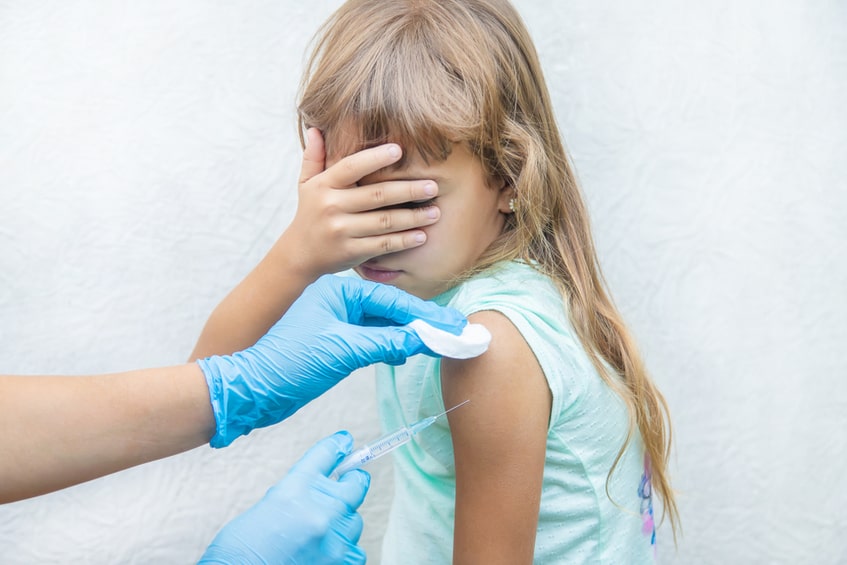
Холдинг «Нацимбио» Госкорпорации Ростех в 2020 году приступает к серийному производству первой отечественной вакцины для профилактики кори, краснухи и паротита у детей. Новый препарат предназначен для иммунизации детей в 12 месяцев и 6 лет.
Вакцина Вактривир уже зарегистрирована Минздравом. Планируется, что первые партии вакцины поступят на рынок в 2020 году. Разработчиком вакцины является научно-производственное объединению «Микроген» (находится под управлением «Нацимбио»). Препарат создан из российских антигенов и будет производиться на мощностях предприятия по полному технологическому циклу.
В настоящее время в России для защиты от трех заболеваний в рамках Национального календаря профилактических прививок используются моновакцины от кори, краснухи и паротита, а также дивакцина паротитно-коревая.
- Создано: 18.11.2019

Минпромторг анонсировал новый метод поддержки российских производителей. Для этого ведомство предлагает обязать государство и госкомпании отдавать определенную часть своего заказа российским поставщикам, а также из других стран ЕАЭС, пишут «Ведомости».
Группы товаров, на которые будет распространяться ограничение, должно определить правительство. Сам Минпромторг предлагает включить в перечень лекарственные препараты и перевязочные материалы, программное обеспечение и компьютеры, рулонные газоны, йод, взрывчатку, вагоны и пр. Квоту также должно определить правительство, но для госзаказа она не может быть меньше 50%.
Сейчас госзаказчики, описывая желаемый товар, используют преимущественно характеристики иностранной продукции, в том числе закупая для нацпроектов, пишет Минпромторг в пояснительной записке. Постоянная квота на долю закупок российских товаров вместе с обязанностью указывать именно их характеристики, станет долговременной точечной поддержкой российского производства, говорится в ней.
Госкомпании, не выполнившие квоту, будут на следующий год переведены на более жесткие правила госзаказа, сказано в законопроекте. Подобная форма поддержки не нова и применяется во многих странах, замечает представитель Минэкономразвития.
- Создано: 18.11.2019
Ещё статьи...
.